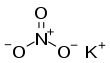যখাৰ

| |||
| |||
| নামসমূহ | |||
|---|---|---|---|
| IUPAC নাম
পটাছিয়াম নাইট্ৰেট
| |||
| অন্যান্য নাম | |||
| চিনাক্তকাৰীসমূহ | |||
ত্ৰিমাত্ৰীয় আৰ্হি (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| ECHA InfoCard | 100.028.926 | ||
| EC Number | |||
| E number | E252 (preservatives) | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS number | {{{value}}} | ||
| UNII | |||
| UN number | 1486 | ||
| |||
| |||
| ধৰ্মসমূহ | |||
| KNO3 | |||
| ম'লাৰ ভৰ | 101.1032 g/mol | ||
| ৰূপ | বগা কঠিন | ||
| গোন্ধ | গোন্ধহীন | ||
| ঘনত্ব | 2.109 g/cm3 (16 °C) | ||
| গলনাংক | 334 °C (সাঁচ:Convert/F K) | ||
| উতলাংক | 400 °C (সাঁচ:Convert/F K) (decomposes) | ||
| 133 g/L (0 °C) 242 g/L (20 °C) 2439 g/L (100 °C)[3] | |||
| দ্ৰৱণীয়তা | ইথানলত সামান্য পৰিমাণে দ্ৰৱণীয় গ্লিছাৰল, এম'নিয়াত দ্ৰৱণীয় | ||
| ক্ষাৰগ্ৰাহিতা (pKb) | 15.3[4] | ||
চৌম্বিক প্ৰৱণতা (χ)
|
−33.7·10−6 cm3/mol | ||
প্ৰতিসৰণাংক (nD)
|
1.335, 1.5056, 1.5604 | ||
| গঠন | |||
| অৰ্থ'ৰম্বিক, আৰাগ'নাইট | |||
| তাপৰসায়ন | |||
| 95.06 J/mol K | |||
Std enthalpy of
formation (ΔfH |
-494.00 kJ/mol | ||
| বিপদসমূহ | |||
| Main hazards | Oxidant, harmful if swallowed, inhaled, or absorbed on skin. Causes irritation to skin and eye area. | ||
| Safety data sheet | ICSC 0184 | ||
| GHS pictograms |  
| ||
| H272, H315, H319, H335 | |||
| P102, P210, P220, P221, P280 | |||
| NFPA 704 | |||
| Flash point | non-flammable (oxidizer) | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
1901 mg/kg (oral, rabbit) 3750 mg/kg (oral, rat)[5] | ||
| সংশ্লিষ্ট যৌগসমূহ | |||
অন্যান্য এনায়ন
|
পটাছিয়াম নাইট্ৰেট | ||
অন্যান্য কেটায়ন
|
লিথিয়াম নাইট্ৰেট ছ'ডিয়াম নাইট্ৰেট ৰুবিডিয়াম নাইট্ৰেট চিজিয়াম নাইট্ৰেট | ||
সংশ্লিষ্ট যৌগসমূহ
|
পটাছিয়াম ছালফেট পটাছিয়াম ক্ল'ৰাইড | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| Infobox references | |||
যখাৰ পটাছিয়ামৰ এবিধ যৌগ। ইয়াৰ ৰাসায়নিক নাম পটাছিয়াম নাইট্ৰেট (KNO3)। ই পটাছিয়াম আয়ন K+ আৰু নাইট্ৰেট আয়ন NO3− ৰ আয়নিক লৱণ, আৰু সেইবাবে এটা ক্ষাৰকীয় ধাতু নাইট্ৰেট। প্ৰকৃতিত ইয়াক নাইটাৰ (niter) নামৰ এক খনিজ পদাৰ্থ হিচাপে পোৱা যায়। যখাৰ বুলিলে পটাছিয়াম নাইট্ৰেটৰ লগতে আন কিছুমান নাইট্ৰ'জেন যৌগকো বুজায়।
বৈশিষ্ট্য
[সম্পাদনা কৰক]যখাৰ এবিধ বগা স্ফটিকাকাৰ পদাৰ্থ। সৰহীয়াকৈ যখাৰ উৎপাদন কৰিবলৈ পটাছিয়াম ক্ল'ৰাইড আৰু ছ'ডিয়াম নাইট্ৰেটৰ দ্ৰৱ তপত অৱস্তহত মিহলি কৰিব লাগে। তেতিয়া ৰাসায়নিক বিক্ৰিয়া ঘটি যখাৰ উৎপন্ন হয়। যখাৰ পানীত মধ্যমীয়াকৈ দ্ৰৱণীয়, কিন্তু তাপমাত্ৰা বাঢ়িলে দ্ৰৱণীয়তাও বাঢ়ে। এই গুণটোৰ সহায়ত পানীৰ পৰা যখাৰ নিষ্কাষণ কৰা হয়। যখাৰৰ উৎপাদন হওঁতে পানী গৰম অৱস্থাত থাকে। পানী চেঁচা হৈ অহাৰ লগে লগে ই বেছি পৰিমাণে যখাৰ দ্ৰৱ অৱস্থত ৰাখিব নোৱাৰে আৰু যখাৰৰ অধঃক্ষেপণ হ'বলৈ ধৰে।[6]
ই এলকহলত দ্ৰৱণীয় নহয় আৰু বিষাক্তও নহয়। বিশেষ ৰাসায়নিক পদাৰ্থৰ লগত ই বিস্ফোৰক বিক্ৰিয়া কৰে কিন্তু অকলে বিস্ফোৰক নহয়।[3]
ব্যৱহাৰ
[সম্পাদনা কৰক]খাৰ-বাৰুদ আৰু আতচবাজী আদি তৈয়াৰ কৰিবৰ বাবে যখাৰ ব্যৱহাৰ কৰা হয়। মাংস সংৰক্ষণৰ কামতো ইয়াক প্ৰাচীন কালৰে পৰা ব্যৱহাৰ কৰি অহা হৈছে।[7]। পটাছিয়াম আৰু নাইট্ৰ'জেন উদ্ভিদৰ বাবে প্ৰয়োজনীয় বাবে ই এবিধ উৎকৃষ্ট সাৰ। সংবেদনশীল দাঁতৰ বাবে আজিকালি ইয়াক টুথপেষ্টৰ উপাদান হিচাপে ব্যৱহাৰ কৰা হয়।[8]
তথ্য সংগ্ৰহ
[সম্পাদনা কৰক]- ↑ Record of Potassium nitrate in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2007-03-09.
- ↑ Gustafson, A. F. (1949). Handbook of Fertilizers - Their Sources, Make-Up, Effects, And Use. পৃষ্ঠা. 25. ISBN 9781473384521. Archived from the original on 2017-02-17. https://web.archive.org/web/20170217085145/https://books.google.com/books?id=-_V9CgAAQBAJ&pg=PT25.
- ↑ 3.0 3.1 B. J. Kosanke; B. Sturman; K. Kosanke; I. von Maltitz; T. Shimizu; M. A. Wilson; N. Kubota; C. Jennings-White et al. (2004). "2". Pyrotechnic Chemistry. Journal of Pyrotechnics. পৃষ্ঠা. 5–6. ISBN 978-1-889526-15-7. Archived from the original on 2016-05-05. https://books.google.com/books?id=Q1yJNr92-YcC&pg=PA5.
- ↑ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ↑ chem.sis.nlm.nih.gov Archived 2014-08-12 at the Wayback Machine
- ↑ দাস, ভুবনমোহন (সম্পাদনা) (১৯৮৭). প্ৰাথমিক বিজ্ঞান কোষ- চতুৰ্থ খণ্ড. প্ৰকাশক গুৱাহাটী: অসম বিজ্ঞান সমিতি. পৃষ্ঠা. ১২১.
- ↑ Binkerd, E. F; Kolari, O. E (1975-01-01). "The history and use of nitrate and nitrite in the curing of meat". Food and Cosmetics Toxicology খণ্ড 13 (6): 655–661. doi:10.1016/0015-6264(75)90157-1. ISSN 0015-6264. http://www.sciencedirect.com/science/article/pii/0015626475901571.
- ↑ "Sensodyne Toothpaste for Sensitive Teeth". 2008-08-03. Archived from the original on August 7, 2007. https://web.archive.org/web/20070807010449/http://us.sensodyne.com/products_freshmint.aspx। আহৰণ কৰা হৈছে: 2008-08-03.
বাহ্যিক সংযোগ
[সম্পাদনা কৰক]| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3, Fe(NO3)2 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb(NO3)3 | Te | I | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3, TlNO3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr | Nd(NO3)3 | Pm | Sm | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac(NO3)3 | Th(NO3)4 | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| ||||||||||||||||||||||||||